Maria Sarapultseva, Alexey Sarapultsev, Svetlana Medvedeva, Irina Danilova,
Artykuł opublikowano w J Dent Anesth Pain Med. 2018 Apr;18(2):89-95. doi: 10.17245/jdapm.2018.18.2.89. Epub 2018 Apr 27.
Nota od redakcji serwisu wand.pl: artykuł podejmuje ciekawy temat – czy prędkość podawania środka znieczulającego ma wpływ na kondycję i stan tkanek przyzębia i tkanek miękkich? Okazuje się, że tak. Wg autorów przepływ środka znieczulającego powoduje uraz tkanek, a stopień tego urazu jest związany wprost z prędkością podawania środka znieczulającego.
Informacja ta ma znaczenie szczególnie w chirurgii i periochirurgii, gdzie na procesy gojenia i powodzenie leczenia ma wpływ kondycja tkanek miękkich.
STRESZCZENIE
Założenia i cel badania
Nieprawidłowe podanie środka znieczulającego podczas znieczulenia miejscowego jest jedną z najważniejszych przyczyn objawów bólowych u pacjentów, u których wykonywane są planowane zabiegi dentystyczne. W bieżącym badaniu oceniono nasilenie uszkodzenia tkanki przyzębia oraz tkanek miękkich występujące przy różnych prędkościach podawania środka znieczulającego.
Metody badania
Badanie przeprowadzono na 50 szczurach płci męskiej o masie ciała 180–240 g. Zastosowanym środkiem znieczulającym była 1% artykaina.
Wyniki
Wyniki wykazały, że podawanie środka znieczulającego w szybkim tempie spowodowało uszkodzenie strukturalne tkanki przyzębia i tkanek miękkich. Ponadto odnotowano oznaki upośledzenia mikrokrążenia przy wszystkich szybkościach podawania. Badania biochemiczne wykazały iż, przy szybkim wprowadzeniem środka znieczulającego występują zmiany w poziomie glukozy i enzymów co wskazuje na silną ogólnoustrojową reakcję stresową organizmu.
Wnioski
Wstrzyknięcie miejscowe środka znieczulającego przy dowolnej prędkości wprowadzenia indukuje przekrwienie w krążeniu mikrokrążeniowym i reakcje wysiękowe. Szybkie wprowadzenie środka znieczulającego powoduje postęp zmian strukturalnych w tkankach miękkich i tkance przyzębia
WPROWADZENIE
Zabiegi i procedury stomatologiczne lub medyczne w okolicy szczękowo-twarzowej lub w jamie ustnej, które mogą wywoływać ból, są wskazaniem do znieczulenia miejscowego. Podanie środków znieczulających miejscowo umożliwia dentystom wykonywanie niemal wszystkich zabiegów dentystycznych niemal bezboleśnie. Jednak podawanie samego środka znieczulającego jest postrzegane przez większość pacjentów jako najbardziej bolesny etap leczenia. Ponadto takie odczucia są często tak wyraźne, że powodują opóźnienie lub odwołanie wizyty u dentysty (1,2,3,4). Podanie znieczulenia miejscowego bez bólu, dyskomfortu lub lęku może również zapobiec powikłaniom układowym, takim jak podwyższone ciśnienie krwi lub omdlenie wazowagalne (5)
Obecnie dostępna jest cała gama dodatkowych metod mających na celu zneutralizowanie bolesnych skutków podawania znieczulenia, w tym znieczulenie powierzchowne, zmodyfikowane igły i strzykawki, a także różne metody sedacji (6). Jednak chociaż skuteczność wielu z tych metod (takich jak żele do aplikacji, atraumatyczne igły) nie została udowodniona (7), wdrożenie innych (sedacja) nie zawsze jest opłacalne ekonomicznie lub metodologicznie.
Ból podczas wykonywania znieczulenia może być powodowany przez następujące czynniki: początkowa penetracja tkanek przez igłę (8,9), ruch igły do miejsca wstrzyknięcia znieczulenia oraz uraz i obrzęk tkanek spowodowany wstrzyknięciem środka znieczulającego (10). Indywidualne cechy pacjenta mogą również zwiększać odczucia bólu podczas podawania znieczulenia miejscowego (2). Poza tym objawy bólowe podczas podawania znieczulenia miejscowego są wywoływane przez mechaniczny uraz i obrzęk tkanek przy podwyższonym ciśnieniu śródtkankowym podczas pierwszych kilku sekund wstrzyknięcia (11) i niedostateczną ilość środka znieczulającego (12). Chociaż istniejące wytyczne dotyczące technik anestezjologicznych zalecają powolne wprowadzanie środka znieczulającego w celu zminimalizowania bólu, to stosowanie ich może nie zawsze być wykonalne w procedurze klinicznej (13, 14, 15, 16).
W kilku badaniach oceniono szybkość podawania środka znieczulającego. Doniesiono, że lekarzowi udało się bezproblemowo zastosować znieczulenie tylko w 14% przypadków, a szybkość podawania znieczulenia zależy od płci lekarza podającego znieczulenie (mężczyźni szybciej podają znieczulenie), doświadczenia (dentyści z większym doświadczeniem szybciej niż studenci) i parametrów igły (z igłą o rozmiarze 30 Gauge, odnotowano czas podawania znieczulenia powyżej 1 minuty w 75% przypadków, podczas gdy odnotowano tylko 47,9% przypadków z igłą 27 Gauge (17,18).
Umiejętne podawanie konieczne do bezbolesnego wstrzyknięcia nie zawsze jest możliwe do osiągnięcia. Nieprawidłowości, takie jak brak utrzymania prostoliniowości podczas wprowadzania, występują w pierwszych trzech sekundach podawania w większości przypadków (75%), co widać po znacznym wysiłku dentysty, aby przesunąć tłok (11). Dodatkowo ciśnienie iniekcji podczas podawania znieczulenia waha się od 17 061 do 34 122 mm Hg, w zależności od rodzaju tkanki i indywidualnych doświadczeń lekarza (19,20).
Dlatego można przypuszczać, że sposób podania środka znieczulającego jest jedną z najważniejszych przyczyn różnicujących poziom bólu odczuwanego przez pacjentów podczas podawania znieczulenia miejscowego. Jednak do tej pory nie było badań oceniających stopień nasilenia reakcji wywołanych stresem i uszkodzenia błony śluzowej jamy ustnej w odpowiedzi na nieprawidłowe wprowadzenie roztworu znieczulającego.
Stąd celem obecnego badania była ocena nasilenia reakcji na stres i uszkodzenia tkanki przyzębia w zależności od techniki podawania (nasiękowe i śródwięzadłowe) i szybkości podawania znieczulenia miejscowego.
MATERIAŁY I METODY
Badanie przeprowadzono na zdrowych, dojrzałych płciowo samcach szczurów, albinosach. Zwierzęta wykorzystane w testach poddano kwarantannie w wiwarium Instytutu Immunologii i Fizjologii Oddziału Ural RAS (Jekaterynburg, Rosja). Zwierzęta nie wykazywały żadnych objawów żadnej choroby. Wszystkie zwierzęta trzymano w standardowych warunkach i karmiono zgodnie ze zwyczajowym harmonogramem. Wszystkie zwierzęta poddawane operacji otrzymały podobny poziom opieki i uwagi. Podczas operacji zastosowano technikę aseptyczną i sterylne narzędzia.
Wszystkie procedury z udziałem zwierząt zostały zatwierdzone przez Komitet ds. Opieki i Użytkowania Zwierząt w Instytucie Immunologii i Fizjologii Oddziału Ural RAS i zostały przeprowadzone zgodnie z zasadami sformułowanymi w Europejskiej Konwencji o Ochronie Zwierząt Kręgowych wykorzystywanych w celach eksperymentalnych i innych celach naukowych (Strasburg, Francja, 18.03.1986); Zasadami przewodnimi APS dotyczącymi opieki i wykorzystania zwierząt kręgowych w badaniach i szkoleniach oraz Przepisami dotyczącymi praktyki laboratoryjnej RF (Ministerstwo Zdrowia Publicznego nr 267 z 19.06. 2003) (21, 22, 23).
Badanie przeprowadzono na 50 szczurach płci męskiej o masie ciała 180–240 g. Zwierzęta zostały podzielone na 5 grup, jak opisano poniżej, w celu uzyskania statystycznie poprawnych wyników. Zróżnicowanie pod względem masy początkowej między grupami nie przekroczyło 10%.
Grupa eksperymentalna A (szybkie wprowadzenie środka znieczulającego) składała się z 10 zwierząt o średniej masie 223 ± 15,0 g. Grupa eksperymentalna B (powolne wprowadzanie środka znieczulającego) składała się z 10 zwierząt o średniej masie 256 ± 12,0 g. Grupa eksperymentalna C (szybkie wprowadzenie znieczulenia śródwięzadłowego) składała się z 10 zwierząt o średniej masie 232 ± 11 g. Grupa eksperymentalna D (powolne wprowadzenie znieczulenia śródwięzadłowego, w ciągu 1 minuty) składała się z 10 zwierząt o średniej masie 240 ± 10 g. Grupa kontrolna I składała się z 10 zwierząt o średniej masie 220 g. Szybkość wstrzyknięcia wybrano zgodnie ze znanym urządzeniem Anaeject® firmy Septodont®, które jest szeroko stosowane w klinikach na całym świecie. W grupie A czas iniekcji wynosił około 30 sekund, a w grupie B około 1 minuty (tryb wolny Anaeject®) (24).
Zwierzęta uprzednio poddano narkozie z użycim 40 mg / kg aethaminalum-natrium, dootrzewnowo. Czynności z udziałem zwierząt zwierząt zakończono po 1,5 godziny od ich podjęcia. Zastosowanym roztworem znieczulającym była 1% artykaina (skład: ultracain D-S roztwór do wstrzykiwań w 2 ml ampułce, roztwór do wstrzykiwań 1,7 ml: chlorowodorek artykainy ― 40 mg / ml; chlorowodorek epinefryny ― 6 mkg / ml). W oparciu o specyficzny metabolizm (przyspieszenie w porównaniu do człowieka) i masę ciała zwierząt doświadczalnych (średnio 240 g), 0,09–0,1 ml roztworu uznano za właściwą objętość do podawania.
Środek znieczulający podawano standardową strzykawką z ampułką za pomocą igły o długości 12 mm, zgodnie z zaleceniami dotyczącymi miejscowego znieczulenia (ampułka jednorazowy A (cal) 0,3 × 12 mm, DEP
Około 3 ml krwi pobrano do analizy biochemicznej metodą kardiocentezy z dalszym wirowaniem i oddzieleniem surowicy. Próbki oceniono za pomocą standardowego analizatora biochemicznego (Beckman Coulter Immunochemistry Systems, USA). Osocze krwi badano pod kątem następujących czynników biochemicznych, które służą jako niespecyficzne markery reakcji stresowej: poziom glukozy i siła enzymu w surowicy transutaminazy glutaminowo-szczawiowej lub AspAT oraz glutaminowa transaminaza pirogronowa lub ALT. Do analiz biochemicznych wykorzystano gotowe zestawy odczynników (Vital Diagnostics; SPb, Rosja). Próbki histologiczne tkanki przyzębia przygotowano zgodnie ze standardowymi praktykami i zabarwiono hematoksyliną i eozyną (25,26).
Do analizy danych wykorzystano oprogramowanie STATISTICA 6.0 (StatSoft, Inc. 2001). Dane są przedstawione w postaci średniej arytmetycznej (M) ± błąd standardowy średniej (m). Aby przetestować hipotezę o jednorodności dwóch niezależnych selekcji, zastosowano nieparametryczny test U Manna-Whitneya. Podczas testowania hipotez statystycznych wykorzystano 5% punkt istotności.
WYNIKI
1. Wyniki badań biochemicznych
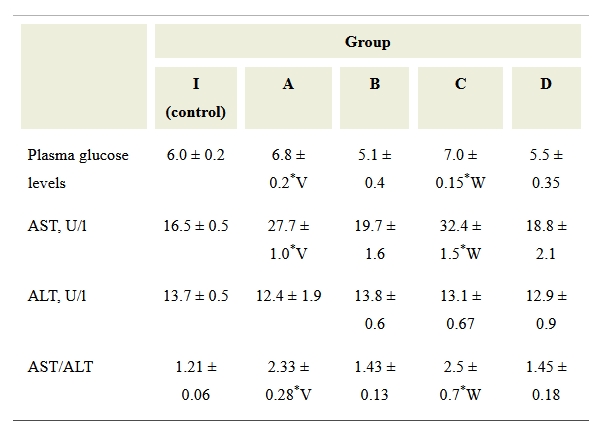
Nieznaczny wzrost poziomu glukozy odnotowano w grupie A 1,5 godziny po szybkim wprowadzeniu roztworu artykainy w porównaniu do wszystkich innych grup (Tabela 1). Poziom ten różnił się od poziomu glukozy u szczurów z grupy B (która przeszła powoli wprowadzenie leku) i w grupie kontrolnej. Wskaźnik glukozy u zwierząt z grupy C przewyższył dodatnio wskaźnik u zwierząt z grupy kontrolnej i grupy D. Ogólnie przyjmuje się, że ALT i AST są najbardziej wiarygodnymi markerami uszkodzenia wątroby i odzwierciedlają uszkodzenie i wzrost przepuszczalności błony hepatocytów . Jednak wzrost aktywności aminotransferazy w surowicy, oprócz uszkodzenia wątroby, może być spowodowany kilkoma innymi czynnikami, takimi jak stres związany z forsownym wysiłkiem fizycznym, dramatyczną utratą masy ciała i hemolizą (27).
Tabela 1.
Wyniki testów biochemicznych (średnia ± SEM)
Statystycznie istotna różnica wartości w przypadku porównania w parach: * P <0,05 w porównaniu ze zwierzętami kontrolnymi; V – P <0,05 w porównaniu między grupami A i B; W – P <0,05 w porównaniu między grupami C i D. U / l – jednostki na litr. AST, aminotransferaza asparaginianowa; ALT, aminotransferaza alaninowa.
Wyniki testów biochemicznych (średnia ± SEM)
W żadnej z grup nie zarejestrowano możliwych do zweryfikowania zmian aktywności ALT w surowicy krwi.
Zwierzęta z grupy A wykazały wzrost aktywności AST (prawie 1,7 razy wyższy) w porównaniu ze szczurami z grupy kontrolnej po szybkim wprowadzeniu środka znieczulającego, podczas gdy różnica tego czynnika w grupie B od grupy kontrolnej nie była możliwa do zweryfikowania. Zwierzęta z grupy C odnotowały znacznie wyższy wzrost aktywności tego enzymu, w porównaniu zarówno z grupą D, jak i grupą kontrolną.
Podwyższony poziom AST wraz z jednoczesnym wzrostem współczynnika AST / ALT (współczynnik DeRitisa większy niż 2) w grupach A i C w porównaniu do tych samych wskaźników w grupach B, D i grupie kontrolnej wskazują, iż proces destrukcji może być obserwowany w różnych częściach ciała. (Tabela 1) (28).
2. Wyniki badań histologicznych
Nie odnotowano zmian strukturalnych w błonie śluzowej dziąseł i strukturach błon śluzowych w grupie kontrolnej (ryc. 1-1).
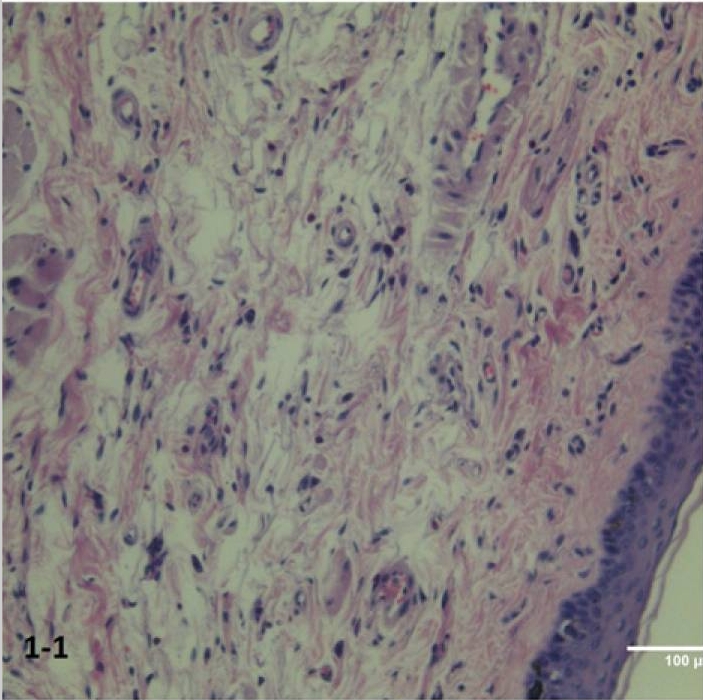
Ryc. 1-1 Grupa kontrolna: tkanki przyzębia. Zmiany histologiczne są nieobecne. Wybarwienie hematoksyliną i eozyną (H&E) (200 ×).
Odmienne wyniki odnotowano w próbkach z grupy A (ryc. 1-2), gdzie stwierdzono uszkodzenie powierzchni z reakcją wysiękową, o czym świadczy infiltracja nabłonka segmentowymi leukocytami. W tkankach głębokich zarejestrowano ognisko krwotoku i zaburzenia mikrokrążenia w postaci ogniskowego zaniku krążenia i złuszczanie komórek śródbłonka (ryc. 1-3).
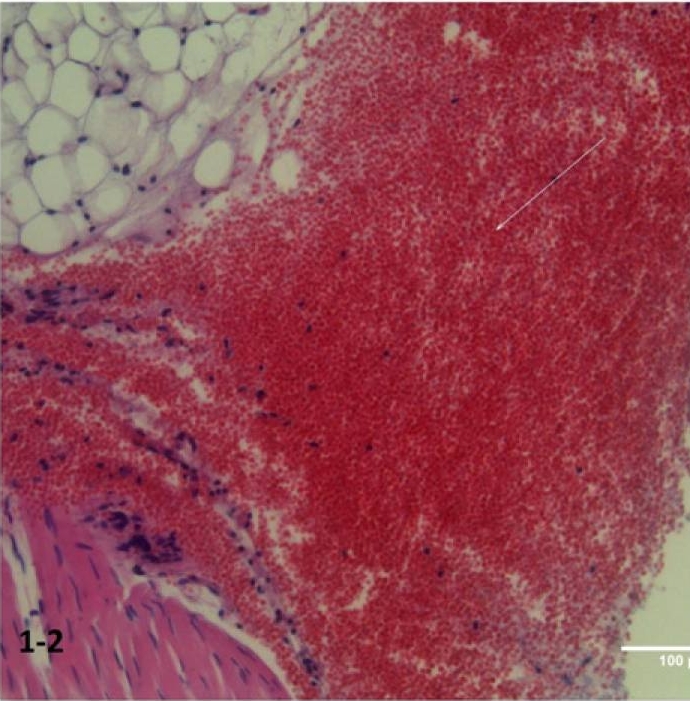
Ryc. 1-2 Grupa A (szybkie wprowadzanie leku): ciężkie naciekanie (strzałka) i objawy aseptycznego stanu zapalnego. Wybarwienie hematoksyliną i eozyną (H&E) (200 ×).
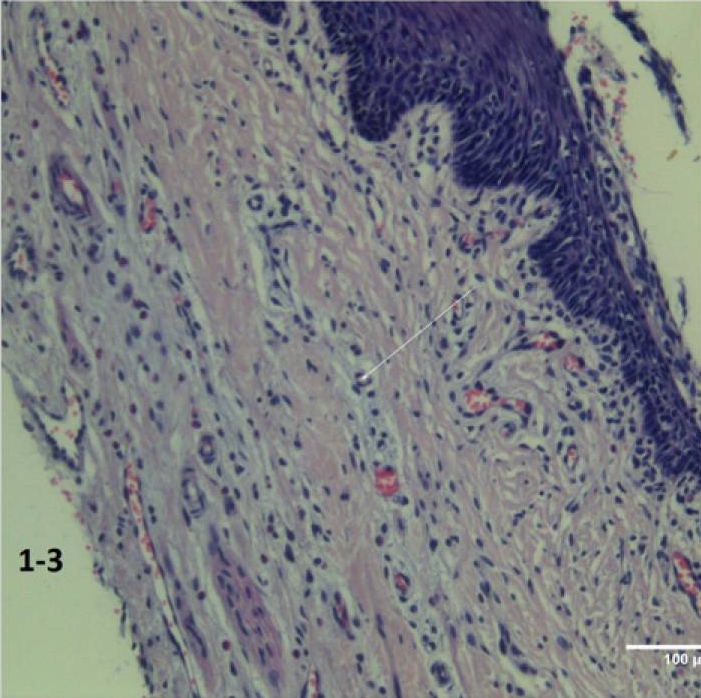
Ryc. 1-3 Grupa A (szybkie wprowadzanie leku): ciężkie naciekanie i objawy aseptycznego zapalenia, skurcz mikronaczyniowy, rozwarstwienie nabłonka. Wybarwienie hematoksyliną i eozyną (H&E) (200 ×).
W grupie kontrolnej B (z powolnym wprowadzaniem środka znieczulającego) zmiany strukturalne w tkance przyzębia były minimalne, a ciągłość nabłonka została zachowana. Jednak ogniskowe przekrwienie odnotowano w mikronaczyniach śródśluzówkowych (ryc. 1-4).
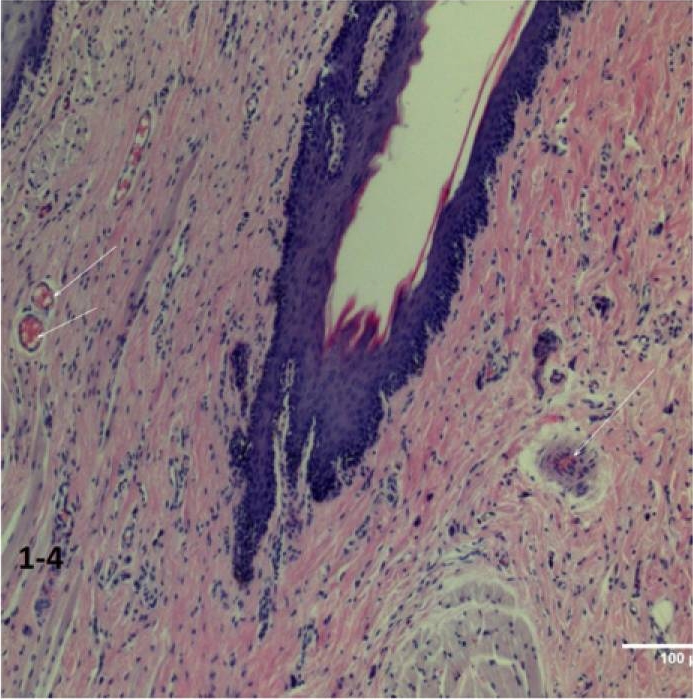
Ryc. 1-4 Grupa B (powolne wstrzykiwanie leku) minimalne oznaki reakcji z krwioobiegu w postaci skurczu naczyń włosowatych (strzałka) i powstawania „kompleksów osadu” (agregacja i aglutynacja czerwonych krwinek). Wybarwienie hematoksyliną i eozyną (H&E) (200 ×).
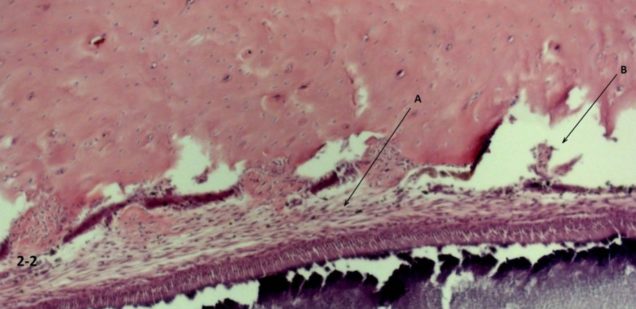
W grupie C (ryc. 2-1) odnotowano oznaki uszkodzenia więzadła przyzębia z umiarkowanym obrzękiem przylegającej błony śluzowej dziąseł i obrzękiem podśluzówkowym. W porównaniu z grupą kontrolną nie zarejestrowano żadnych uszkodzeń strukturalnych w grupie D, zarejestrowano natomiast umiarkowany obrzęk śródmiąższowy tkanek łącznych (ryc. 2-2)
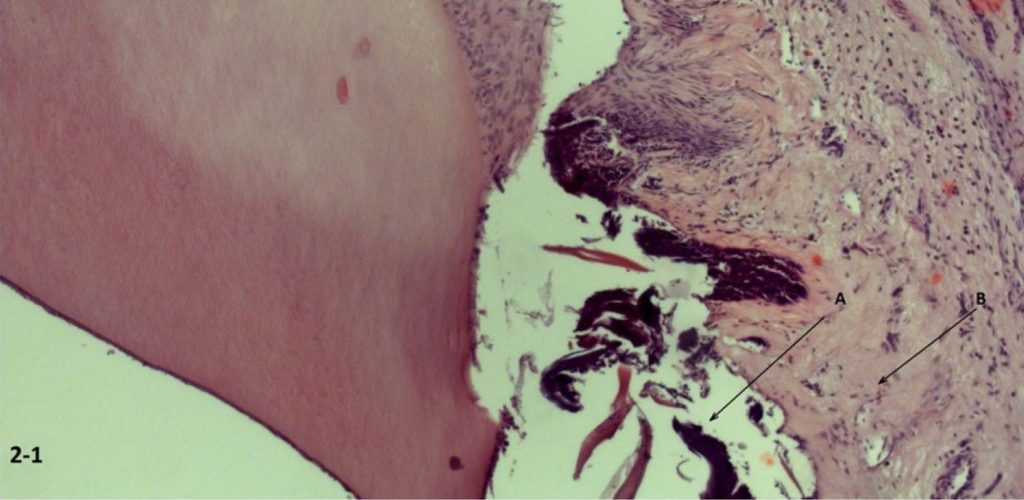
Ryc. 2-1 Grupa C ( szybkie wprowadzenie leku śródwięzadłowo) zniszczenie więzadeł ozębnej (B) z umiarkowanym obrzękiem błony śluzowej i podśluzówkowej (A) sąsiadujących tkanek. Wybarwienie hematoksyliną i eozyną (H&E) (200 ×).
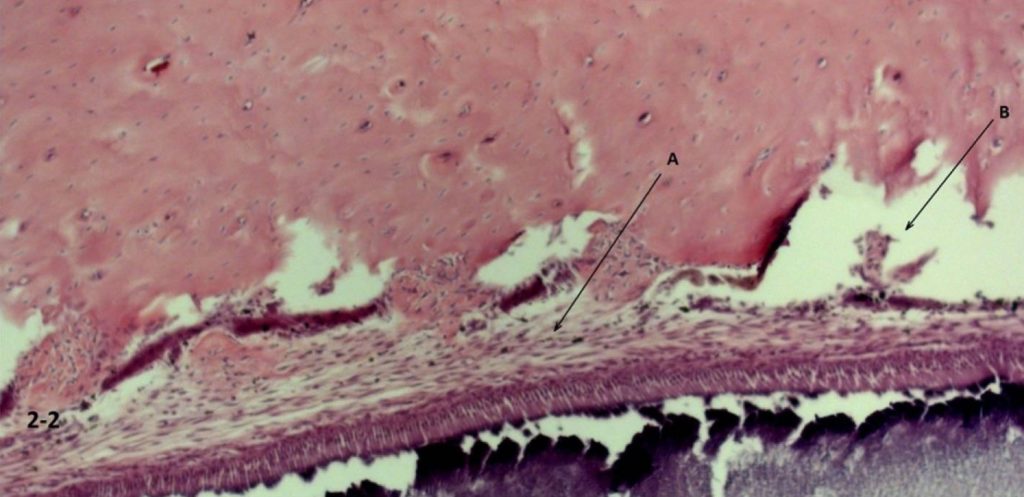
Ryc. 2-2 Grupa C ( szybkie wprowadzenie leku śródwięzadłowo) zniszczenie więzadeł ozębnej (A) z umiarkowanym obrzękiem błony śluzowej i podśluzówkowej (B) przyległych tkanek. Wybarwienie hematoksyliną i eozyną (H&E) (200 ×).
DYSKUSJA
Zgodnie z wynikami badań biochemicznych, obniżenie poziomu glukozy zaobserwowano u zwierząt z grup A i C (które poddano szybkiemu wprowadzeniu środka znieczulającego nasiękowo lub śródwięzadłowo), w porównaniu ze zwierzętami z grupy kontrolnej I. Utraty nie odnotowano u zwierząt z grup B i D. Wydaje się, że taka utrata glukozy przy szybkim wprowadzeniu znieczulenia sugeruje rozwój reakcji stresowej wraz z mobilizacją zasobów energetycznych na początkowych etapach (29).
Najwyraźniej zmian poziomu glukozy nie można wytłumaczyć wzrostem poziomu katecholaminy w surowicy (30), ponieważ jest on zależny od dawki i objawia się przez kilka minut do pół godziny (31), podczas gdy analizę biochemiczną przeprowadzono po 1,5 godziny . Wydaje się, że jest to objaw postępującej reakcji stresowej, o czym świadczą także zmiany aktywności enzymów AST i wzrost współczynnika DeRitisa (28). Ustalono, że AST jest w mniejszym stopniu składnikiem serca, wątroby, nerek, mięśni szkieletowych, tkanek nerwowych, a także gruczołu trzustkowego, śledziony i płuc. Stąd podwyższenie poziomu tego enzymu we krwi sugeruje progresję początkowego etapu uogólnionej reakcji stresowej (32).
Zgodnie z wynikami histologicznymi oznaki upośledzenia mikrokrążenia rejestrowano przy dowolnej prędkości wprowadzenia znieczulającego, co świadczy o zespole postępującej adaptacji (33). Jednak możliwą przyczyną tych zaburzeń może być obecność środków zwężających naczynia krwionośne (chlorowodorek adrenaliny) powszechnie stosowanych w znieczuleniu miejscowym.
Środki zwężające naczynia krwionośne są zwykle integrowane w roztworach znieczulających, aby ułatwić skurcz naczyń w miejscu wstrzyknięcia, co z kolei zapobiega szybkiemu zmniejszeniu znieczulenia, wzmacniając w ten sposób jego funkcję. Dodatkowo, środki te powodują wydłużenie i wzmocnienie działania przeciwbólowego z powodu działania hamującego na włókna mielinowane (34,35). Zastosowanie składników zwężających naczynia umożliwia także zmniejszenie ogólnego stężenia środka znieczulającego w organizmie i zapobiega postępowi centralnych reakcji toksycznych (34,35).
Niemniej jednak zmiany morfologiczne są odnotowywane w miejscu wstrzyknięcia, niezależnie od ilości wprowadzonego leku (ze środkiem zwężającym naczynia krwionośne), co sugeruje postęp aseptycznej martwicy krzepnięcia wraz z postępującym reaktywnym zapaleniem w obszarze wprowadzania leków (36).
Jednak, jak zauważono w niniejszym badaniu, postęp martwicy nie był nieunikniony i zależał od szybkości wprowadzania środka znieczulającego. Przy niskiej prędkości wprowadzania roztworu znieczulającego rejestrowano minimalne oznaki reakcji w postaci zwężenia naczyń włosowatych i tworzenia agregatu erytrocytów (agregacja i aglutynacja krwinek czerwonych) (grupa B, ryc. 1-4).
Takie zmiany w mikrokrążeniu zostały również zarejestrowane przez innych badaczy, którzy zasugerowali, że przy stężeniu adrenaliny wynoszącym 1: 50 000, w miejscu wprowadzenia następuje pełne zatrzymanie krążenia, które rozwija się przez 20–30 s i trwa przez 15–20 min (37 , 38). Niemniej jednak uszkodzenie nabłonka wraz rozwijającą się reakcją wysiękową zaobserwowano w bieżącym badaniu jedynie po szybkim wprowadzeniu środka znieczulającego.
Obecność lub brak objawów martwicy po wprowadzeniu środka znieczulającego zależy od prędkości podawania oraz rodzaju tkanki i ciśnienia wstrzyknięcia roztworu (37, 38). Stąd pojawienie się zmian martwiczych w miejscach wprowadzenia środków znieczulających za pomocą środków zwężających naczynia krwionośne, jak opisano w literaturze (36), można wytłumaczyć nieadekwatnością modelu stosowanego przez autorów (środek znieczulający wstrzykuje się w tkankę mięśniową, a nie w błonę śluzową lub więzadła ozębnej).
Podobnie, podczas podawania znieczulenia śródwięzadłowo, niezależnie od szybkości wprowadzenia znieczulenia (grupy C i D, ryc. 1 i 2) ( od red.: urządzeniem Anaeject) , zaobserwowano zniszczenie więzadła ozębnej, co można wiązać z uszkodzeniem tkanek spowodowanym wysokim ciśnieniem roztworu podczas podawania tego rodzaju znieczulenia.
Podsumowując, wstrzyknięcie środka znieczulającego miejscowo przy dowolnej prędkości wprowadzania indukuje odpowiedź w postaci przekrwienia naczyń mikrokrążenia i reakcjach wysiękowych.
Szybkie wprowadzenie środka znieczulającego powoduje postęp zaburzeń w strukturze tkankach miękkich i tkankach przyzębia.
Zmiany poziomu glukozy i enzymów po szybkim wprowadzeniu miejscowych środków znieczulających wskazują na ciężką ogólnoustrojową reakcję stresową organizmu przy tego rodzaju wprowadzeniu.
LITERATURA REFERENCYJNA
1. Milgrom P, Coldwell SE, Getz T, Weinstein P, Ramsay DS. Four dimensions of fear of dental injections. J Am Dent Assoc. 1997;128:756–762. (PubMed) (Google Scholar)
2. Abrahamsson KH, Berggren U, Hallberg L, Carlsson SG. Dental phobic patients’ view of dental anxiety and experiences in dental care: a qualitative study. Scand J Caring Sci. 2002;16:188–196. (PubMed) (Google Scholar)
3. Weinstein P, Shimono T, Domoto P, Wohlers K, Matsumura S, Ohmura M, et al. Dental fear in Japan: Okayama Prefecture school study of adolescents and adults. Anesth Prog. 1992;39:215–220. (PMC free article) ([PubMed) (Google Scholar)
4. Tzafalia M, Sixou JL. Administration of anesthetic solutions using a metal syringes. An ex vivo study. Anesth Prog. 2011;58:61–65. (PMC free article) (PubMed) (Google Scholar)
5. Saijo M, Ito E, Ichinohe T, Kaneko Y. Lack of pain reduction by a vibrating local anesthetic attachment: a pilot study. Anesth Prog. 2005;52:62–64. (PMC free article) (PubMed) (Google Scholar)
6. Jacobs S, Haas DA, Meechan JG, May S. Injection pain: comparison of the three mandibular block techniques and modulation by nitrous oxide. J Am Dent Assoc. 2003;134:869–876. (PubMed) (Google Scholar)
7. Flanagan T, Wahl MJ, Schmitt MM, Wahl JA. Size doesn’t matter: needle gauge and injection pain. Gen Dent. 2007;55:216–217. (PubMed) (Google Scholar)
8. Meechan JG, Howlett PC, Smith BD. Factors influencing the discomfort of intraoral needle penetration. Anesth Prog. 2005;52:91–94. (PMC free article) (PubMed) (Google Scholar)
9. Nakanishi O, Haas D, Ishikawa T, Kameyama S, Nishi M. Efficacy of mandibular topical anesthesia varies with the site of administration. Anesth Prog. 1996;43:14–19. (PMC free article) (PubMed) (Google Scholar)
10. Kaufman E, Epstein JB, Naveh E, Gorsky M, Gross A, Cohen G. A survey of pain, pressure, and discomfort induced by commonly used oral local anesthesia injections. Anesth Prog. 2005;52:122–127. (PMC free article)(PubMed) (Google Scholar)
11. Meechan JG. Pain control in local analgesia. Eur Arch Paediatr Dent. 2009;10:71–76. (PubMed) (Google Scholar)
12. Primosch RE, Brooks R. Influence of anesthetic flow rate delivered by the Wand Local Anesthetic System on pain response to palatal injections. Am J Dent. 2002;15:15–20. (PubMed) (Google Scholar)
13. Kudo M. Initial injection pressure for dental local anesthesia: effects on pain and anxiety. Anesth Prog. 2005;52:95–101. (PMC free article) (PubMed) (Google Scholar)
14. Pashley EL, Nelson R, Pashley DH. Pressures created by dental injections. J Dent Res. 1981;60:1742–1748. (PubMed)([Google Scholar)
15. Sumer M, Misir F, Koyuturk AE. Comparison of the Wand with a conventional technique. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006;101:e106–e109. (PubMed) (Google Scholar)
16. Versloot J, Veerkamp JS, Hoogstraten J. Computerized anesthesia delivery system vs. traditional syringe: comparing pain and pain-related behavior in children. Eur J Oral Sci. 2005;113:488–493. (PubMed) (Google Scholar)
17. Meechan JG. Differences between men and women regarding attitudes toward dental local anesthesia among junior students at a United Kingdom dental school. Anesth Prog. 2005;52:50–55. (PMC free article) (PubMed) (Google Scholar)
18. Rankin JA, Harris MB. Comparison of stress and coping in male and female dentists. J Dent Pract Adm. 1990;7:166–172. (PubMed) (Google Scholar)
19. Hochman MN, Friedman MJ, Williams W, Hochman CB. Interstitial tissue pressure associated with dental injections: a clinical study. Quintessence Int. 2006;37:469–476. (PubMed) (Google Scholar)
20. Walmsley AD, Lloyd JM, Harrington E. Pressures produced in vitro during intraligamentary anaesthesia. Br Dent J. 1989;167:341–344. (PubMed) (Google Scholar)
21. Clark JD, Gebhart GF, Gonder JC, Keeling ME, Kohn DF. The 1996 Guide for the care and use of laboratory animals. ILAR J. 1997;38:41–48. (PubMed) (Google Scholar)
22. Flecknell PA. Laboratory animal anesthesia. London: Academic Press; 1987. (Google Scholar)
23. Swindle MM, Adams RJ. Experimental surgery and physiology: induced animal models of human disease. Baltimore: Williams & Wilkins; 1988. (Google Scholar)
24. Baart JA, Brand HS Microprocessor-Aided Local Anaesthesia, editors. Local Anaesthesia in Dentistry. 2Ed. Springer International Publishing; 2017. pp. 113–123. (Google Scholar)
25. Lillie RD. HJ Conn’s Biological Stains. 4th ed. Baltimore: Williams and Wilkins; 1977. (Google Scholar)
26. Bancroft JD, Stevens A. Theory and Practice of Histological Techniques. 4th ed. New York: Churchill Livingstone; 1996. (Google Scholar)
27. Pratt DS, Kaplan MM. Evaluation of abnormal liver enzyme results in asymptomatic patients. N Engl J Med. 2000;342:1266–1271. (PubMed) (Google Scholar)
28. De Ritis F, Coltorti M, Giusti G. An enzymic test for the diagnosis of viral hepatitis: the transaminase serum activities. 1957. Clin Chim Acta. 2006;369:148–152. (PubMed) (Google Scholar)
29. Selye H. Stress in health and disease. Boston: Butterworths; 1976. (Google Scholar)
30. Cioffi GA, Chernow B, Glahn RP, Terezhalmy GT, Lake CR. The hemodynamic and plasma catecholamine responses to routine restorative dental care. J Am Dent Assoc. 1985;111:67–70. (PubMed) (Google Scholar)
31. Jastak JT, Yagiela JA. Vasoconstrictors and local anesthesia: a review and rationale for use. J Am Dent Assoc. 1983;107:623–630. (PubMed) (Google Scholar)
32. American Gastroenterological Association. American Gastroenterological Association medical position statement: evaluation of liver chemistry tests. Gastroenterology. 2002;123:1364–1366. (PubMed) (Google Scholar)
33. Selye H. The story of the adaptation syndrome. Am J Med Sci. 1952;224:711. (Google Scholar)
34. Grizuk SF. Oral and Maxillofacial Surgery. Moscow: Geotar-Media; 2010. (In Russian) (PubMed) (Google Scholar)
35. Sisk AL. Vasoconstrictors in local anesthesia for dentistry. Anesth Prog. 1992;39:187–193. (PMC free article][/PubMed)])(PubMed) (Google Scholar)
36. Ibragimov ZI, Semkin VA, Didikin SS, Titova GP. Features of the morphological changes of skeletal muscles after intramuscular administration of anesthetics. Alfavit stomatologii. 2007;1:42–44. (In Russian)(PubMed) (Google Scholar)
37. Zoryan EV, Rabinovich SA. Vasoconstrictive agents in composition of local anesthetics: significance and problems. Clin Dent. 2006;3:24–28. [In Russian][/In] [Google Scholar][/Google]
38. Rabinovich SA, Kuznetzov GI, Moscowez ON, Zoryan EV. Int Dent Rev. 2008;1:14–15. (In Russian) (Google Scholar)